jueves, 18 de octubre de 2018
BIBLIOGRAFÍA
- Raymond Chang, "Quimica" Sexta Edición, McGraw-Hill Pág. 248 – 250.
- Whitten, "Química General" Quinta Edición, McGraw-Hill Pág. 348–216–218–174.
- Principios de Química, Pág. 84 -85–95–96–97.
- Microsoft Encarta 2002
- J. B. Russell, "Química" McGRaw-Hill / Interamericana de México
- Geoff Rayner, "Química Inorgánica Descriptiva" Segunda Edición, Prentice Hall.
FUENTES DE CONSULTA
https://www.monografias.com/trabajos12/taper/taper.shtml
https://deconceptos.com/ciencias-naturales/tabla-periodica
https://historia-biografia.com/historia-de-la-tabla-periodica/
https://paraquesirven.com/para-que-sirve-la-tabla-periodica/
https://youtu.be/PsW0sGF5EBE
CONCLUSIÓN
- Se conoce que en la tabla periódica existen 5 características de los elementos las cuales son: los elementos que son metales, los no metales, metales de transición, metaloides y los gases nobles o inherentes, pero los de mayor abundancia son los elementos metálicos la cuales gobierna casi toda la tabla periódica.
- La tabla periódica está organizada en grupos y periodos las cuales son 18 grupos y que cada grupo está caracterizado por el elemento que los representa y son 7 periodos las cuales esta organizados por medio de la característica química semejantes a los demás.
- Relacionando este tema con la química moderna pues es de mucha importancia para esas personas que estudian medicina, ingeniería entre otros ya que ellos se encargan de estudiar perfectamente las propiedades de los elementos las cuales lo utilizan para crear antibióticos, medicina, creación de chips entre otros.
- Por medio de la investigación realizada nos es útil para conocer que en nuestro universo no solo existen unos cuantos elementos como lo son más comunes: oro, plata, calcio, oxigeno, cobre, hierro, hidrogeno, yodo, carbono, mercurio etc. Sino que en nuestro universo existen 118 elementos y que están bien organizado en la tabla periódica y por ello los resultado es sobre la química moderna, sin ello no existirían las medicinas y mucho menos la anestesia que lo usan los médicos para que la persona no sienta ningún dolor por lo tanto gracias a la química es por eso que estamos vivimos y rodeados de la comodidad.
TRABAJOS DE NIELS BHOR
En 1913, el físico danés Niels Bohr revisó radicalmente el concepto de la emisión de radiación por partículas eléctricamente cargadas que se mueven en órbitas en el interior del átomo, a la que hasta entonces se había aplicado la teoría electromagnética del físico británico James Clerk Maxwell. Bohr introdujo un modelo que combinaba la teoría clásica de Maxwell con la teoría cuántica de Planck. Empleando esa teoría híbrida, Bohr obtuvo una fórmula general para la radiación emitida por el átomo de hidrógeno, que no sólo proporcionaba las longitudes de onda de las líneas de Balmer, sino que predecía correctamente otras series de líneas que se observaron posteriormente en la zona ultravioleta e infrarroja del espectro del hidrógeno.
El razonamiento de Bohr era que la existencia de un átomo como el hidrógeno, formado por un protón cargado positivamente y un electrón cargado negativamente que gira alrededor de él, sólo se puede entender a partir de una determinada distancia básica entre ambos que explique las dimensiones estables del átomo (es decir, que explique por qué el electrón no "cae" en el núcleo). Como las consideraciones dimensionales demuestran que esta distancia no puede obtenerse mediante una combinación matemática que implique exclusivamente la carga del electrón, e, y su masa, m, Bohr argumentó que había que introducir en la teoría atómica otra constante física fundamental que, combinada adecuadamente con las constantes e y m, proporcionara la distancia buscada. Bohr halló que la constante de Planck, h, cumplía bien ese cometido, y sugirió que la distancia básica venía dada por la combinación matemática:
El valor de esta distancia es de 5,29·10-11 m, que constituye el llamado radio de Bohr del átomo de hidrógeno. Este valor también se denomina radio de la primera órbita de Bohr. Bohr utilizó un concepto revolucionario y totalmente opuesto a la física clásica, introducido por la teoría cuántica. Según este concepto, existe una cantidad física llamada acción que está cuantizada en unidades de valor h (lo que significa que no puede haber una acción menor que h). Bohr explicó la estabilidad del átomo de hidrógeno asignando una única unidad de acción a la primera de las llamadas órbitas de Bohr. Con ello se eliminaba cualquier posible órbita más pequeña, porque una órbita así tendría una acción menor que h, lo que violaría la hipótesis cuántica. A continuación, Bohr supuso que cada órbita permitida del electrón, a medida que se aleja del protón, difiere de la órbita inmediatamente anterior en una única unidad de acción h. Por tanto, la acción de la segunda órbita debe ser 2h, la acción de la tercera órbita 3h, y así sucesivamente. Esto significa que la acción de la órbita número n, donde n es un entero, debe ser nh, y entonces se puede demostrar que el radio de la n-ésima órbita tiene que ser:
Por la dinámica clásica, Bohr sabía que la energía total cinética y potencial de una partícula que se mueve en una órbita circular es negativa, porque la energía potencial negativa de la órbita es mayor que su energía cinética (que es positiva). Además, la energía total es inversamente proporcional al radio de la órbita. Por tanto, asignó a la energía del electrón en la órbita n-ésima el valor:
multiplicando la inversa del radio por e2/2 y cambiando su signo por motivos dimensionales. Cuando el electrón salta de la órbita n-ésima a la órbita k-ésima, experimenta un cambio de energía igual a:
o
Este cambio aparece en la forma de un único cuanto de energía, o fotón, emitido o absorbido. Cuando k es mayor que n, se absorbe un fotón; cuando k es menor que n, se emite un fotón.
Así, se llega a la fórmula de Bohr para la inversa de la longitud de onda del fotón emitido cuando el electrón salta de la órbita n a la órbita k, al igualar la fórmula anterior con signo cambiado y la energía del fotón, hc/ë. Esto proporciona la ecuación:
La cantidad:
se conoce como constante de Rydberg, R, en honor al físico sueco Robert Johannes Rydberg
Procedimiento experimental
Experimento n° 01: análisis espectral cualitativo
Materiales y reactivos
- Mechero Bunsen
- Alambre de platino o nicrón
- 7 tubos de ensayo
Soluciones de:
- HCl concentrado
- NaCl
- KCl
- LiCl
- CaCl2
- SrCl2
- BaCl2
Procedimiento:
1. Tome el alambre de icrón e introdúzcalo en la parte incolora de la llama del mechero de Bunsen; si la llama se colorea es que existe impureza en el alambre; para quitarla se sumerge el alambre en el tubo de ensayo que contiene el HCl conc., y se lleva nuevamente a la llama. Esta operación se repite varias veces hasta que el alambre no coloree la llama del mechero.
2. Caliente el alambre, toque en él un poco de NaCl y llévelo a la parte azul de la llama. Observe qué color se produce en la llama y anote.
3. Luego se prosigue con las demás soluciones.
Cuestionario
- ¿Qué es un cuanto, qué es un fotón?
- Planck le dio el nombre de cuanto a la mínima cantidad de energía que podía ser emitida o absorbida en forma de radiación electromagnética.Einstein sugirió que un rayo de luz es en realidad una corriente de partículas de luz, que ahora se conocen como fotones.Los espectros de emisión de los átomos en la fase gaseosa no muestran una distribución continua de de longitudes de onda desde el rojo al violeta; en lugar de ello, los átomos producen líneas brillantes en diferente partes del espectro visible. Estos espectros de líneas corresponden a las emisiones de luz sólo a longitudes de ondas específicas.La forma de espectro más sencilla, llamada espectro continuo, es la emitida por un cuerpo sólido o líquido que puede ser llevado hasta altas temperaturas. Estos espectros no presentan líneas porque contienen luz de todos los colores, que se suceden sin solución de continuidad como en un arco iris.
- ¿Qué es un espectro de líneas y espectro continuo?Cuando a través de un gas a muy baja presión en un tubo de vacío se pasa una corriente eléctrica, la luz que emite el gas se dispersa por un prisma en diferentes líneas, tal espectro de emisión se describe como un espectro de líneas brillantes; pero cuando iluminamos u gas con un haz de luz blanca y analizar el haz que emerge encontramos que solo se han absorbido ciertas longitudes de onda, tal espectro de absorción redescribe como un espectro de líneas opacas.
- Diferencias entre espectro de emisión y espectro absorción.
- ¿A qué se debe el color de la llama al excitar un átomo?
El color que observamos es parte del espectro de emisión que el ojo puede percibir. Nosotros al darle calor el átomo se excita, succión a un nivel superior, y está cuando regresa a su estado original emite energía con una determinada longitud de onda. Esta longitud de onda se encuentra en el rango visible: 380 nm – 700 nm.
5. Llenar el siguiente cuadro de resultados.
CLORUROS
|
FÓRMULA
|
COLOR DE LA LLAMA
|
LÍNEA CARACT.
|
Sodio
Potasio
Litio
Calcio
Estroncio
Bario
|
NaCl
KCl
LiCl
CaCl2
SrCl2
BrCl2
|
Amarillo
Lila
Carmesí
Indigo
Azul
Verde amarillento
|
5890 Å
4044 Å
6708 Å
4226 Å
4607 Å
5535 Å
|
6 ¿Presentan los elementos los mismos espectros? Explique su respuesta.
Cada elemento tiene su propio espectro debido a que los diferentes colores o longitudes de onda (y, por tanto, las diferentes energías) de los cuantos de luz emitidos o absorbidos por un átomo o molécula, dependen de la estructura de éstos y de los posibles movimientos periódicos de las partículas que los componen, ya que estos dos factores determinan la energía total (potencial y cinética) del átomo o molécula.
7. Se tiene una solución problema, en la cual se identificarán qué elemento o elementos se encuentran presentes
Las líneas características de un espectro atómico se pueden usar en análisis químico para identificar átomos desconocidos, igual que las huellas digitales sirven para identificar a una persona. Cuando las líneas del espectro de emisión de un elemento conocido coinciden con las líneas de un espectro de emisión de una muestra desconocida rápidamente se identifica a ésta.
TEORÍA CUÁNTICA
El desarrollo de la teoría cuántica y su aplicación a la estructura atómica, enunciada por el físico danés Niels Bohr y otros científicos, ha aportado una explicación fácil a la mayoría de las características detalladas del sistema periódico. Cada electrón se caracteriza por cuatro números cuánticos que designan su movimiento orbital en el espacio. Por medio de las reglas de selección que gobiernan esos números cuánticos, y del principio de exclusión de Wolfgang Pauli, que establece que dos electrones del mismo átomo no pueden tener los mismos números cuánticos, los físicos pueden determinar teóricamente el número máximo de electrones necesario para completar cada capa, confirmando las conclusiones que se infieren del sistema periódico.
Desarrollos posteriores de la teoría cuántica revelaron por qué algunos elementos sólo tienen una capa incompleta (en concreto la capa exterior, o de valencia), mientras que otros también tienen incompletas las capas subyacentes. En esta última categoría se encuentra el grupo de elementos conocido como lantánidos, que son tan similares en sus propiedades que Mendeléiev llegó a asignarle a los 14 elementos un único lugar en su tabla.
Sistema Periódico Largo
La aplicación de la teoría cuántica sobre la estructura atómica a la ley periódica llevó a reformar el sistema periódico en la llamada forma larga, en la que prima su interpretación electrónica. En el sistema periódico largo, cada periodo corresponde a la formación de una nueva capa de electrones. Los elementos alineados tienen estructuras electrónicas estrictamente análogas. El principio y el final de un periodo largo representan la adición de electrones en una capa de valencia; en la parte central aumenta el número de electrones de una capa subyacente.
Procedimiento Experimental
Experimento N°01: Relación de las familias de los elementos químicos
Se tratará de dar especial atención a las propiedades características de uno o dos elementos comunes en cada grupo y las relaciones entre sus propiedades y aquellas de sus congéneres en el grupo.
Estudiaremos experimentalmente las variaciones en el carácter electropositivo y electronegativo de los elementos. El carácter electropositivo será identificado con las tendencias ácidas de los compuestos que forman los no metales. Para ello hemos escogido los elementos de los grupos I, II y III (metales) y el grupo VII (no metales).
TEORÍA DE LA CAPA ELECTRÓNICA

En la clasificación periódica, los gases nobles, que no son reactivos en la mayoría de los casos (valencia = 0), están interpuestos entre un grupo de metales altamente reactivos que forman compuestos con valencia +1 y un grupo de no metales también muy reactivos que forman compuestos con valencia -1. Este fenómeno condujo a la teoría de que la periodicidad de las propiedades resulta de la disposición de los electrones en capas alrededor del núcleo atómico. Según la misma teoría, los gases nobles son por lo general inertes porque sus capas electrónicas están completas; por lo tanto, otros elementos deben tener algunas capas que están sólo parcialmente ocupadas, y sus reactividades químicas están relacionadas con los electrones de esas capas incompletas. Por ejemplo, todos los elementos que ocupan una posición en el sistema inmediatamente anterior a un gas inerte, tienen un electrón menos del número necesario para completar las capas y presentan una valencia -1 y tienden a ganar un electrón en las reacciones. Los elementos que siguen a los gases inertes en la tabla tienen un electrón en la última capa, y pueden perderlo en las reacciones, presentando por tanto una valencia +1.
Un análisis del sistema periódico, basado en esta teoría, indica que la primera capa electrónica puede contener un máximo de 2 electrones, la segunda un máximo de 8, la tercera de 18, y así sucesivamente. El número total de elementos de cualquier periodo corresponde al número de electrones necesarios para conseguir una configuración estable. La diferencia entre los subgrupos A y B de un grupo dado también se puede explicar en base a la teoría de la capa de electrones. Ambos subgrupos son igualmente incompletos en la capa exterior, pero difieren entre ellos en las estructuras de las capas subyacentes. Este modelo del átomo proporciona una buena explicación de los enlaces químicos.
DESARROLLO HISTÓRICO
Como resultado de los descubrimientos que establecieron en firme la teoría atómica de la materia en el primer cuarto del siglo XIX, los científicos pudieron determinar las masas atómicas relativas de los elementos conocidos hasta entonces. El desarrollo de la electroquímica durante ese periodo por parte de los químicos británicos Humphry Davy y Michael Faraday condujo al descubrimiento de nuevos elementos.
En 1829 se habían descubierto los elementos suficientes para que el químico alemán Johann Wolfgang Döbereiner pudiera observar que había ciertos elementos que tenían propiedades muy similares y que se presentaban en tríadas: cloro, bromo y yodo; calcio, estroncio y bario; azufre, selenio y teluro, y cobalto, manganeso y hierro. Sin embargo, debido al número limitado de elementos conocidos y a la confusión existente en cuanto a la distinción entre masas atómicas y masas moleculares, los químicos no captaron el significado de las tríadas de Döbereiner.
El desarrollo del espectroscopio en 1859 por los físicos alemanes Robert Wilhelm Bunsen y Gustav Robert Kirchhoff, hizo posible el descubrimiento de nuevos elementos. En 1860, en el primer congreso químico internacional celebrado en el mundo, el químico italiano Stanislao Cannizzaro puso de manifiesto el hecho de que algunos elementos (por ejemplo el oxígeno) poseen moléculas que contienen dos átomos. Esta aclaración permitió que los químicos consiguieran una "lista" consistente de los elementos.
Estos avances dieron un nuevo ímpetu al intento de descubrir las interrelaciones entre las propiedades de los elementos. En 1864, el químico británico John A. R. Newlands clasificó los elementos por orden de masas atómicas crecientes y observó que después de cada siete elementos, en el octavo, se repetían las propiedades del primero. Por analogía con la escala musical, a esta repetición periódica la llamó ley de las octavas. El descubrimiento de Newlands no impresionó a sus contemporáneos, probablemente porque la periodicidad observada sólo se limitaba a un pequeño número de los elementos conocidos.
- Mendeléiev y Meyer La ley química que afirma que las propiedades de todos los elementos son funciones periódicas de sus masas atómicas fue desarrollada independientemente por dos químicos: en 1869 por el ruso Dmitri I. Mendeléiev y en 1870 por el alemán Julius Lothar Meyer. La clave del éxito de sus esfuerzos fue comprender que los intentos anteriores habían fallado porque todavía quedaba un cierto número de elementos por descubrir, y había que dejar los huecos para esos elementos en la tabla. Por ejemplo, aunque no existía ningún elemento conocido hasta entonces con una masa atómica entre la del calcio y la del titanio, Mendeléiev le dejó un sitio vacante en su sistema periódico. Este lugar fue asignado más tarde al elemento escandio, descubierto en 1879, que tiene unas propiedades que justifican su posición en esa secuencia. El descubrimiento del escandio sólo fue parte de una serie de verificaciones de las predicciones basadas en la ley periódica, y la validación del sistema periódico aceleró el desarrollo de la química inorgánica.
El sistema periódico ha experimentado dos avances principales desde su formulación original por parte de Mendeléiev y Meyer. La primera revisión extendió el sistema para incluir toda una nueva familia de elementos. Este grupo comprendía los tres primeros elementos de los gases nobles o inertes, argón, helio y neón, descubiertos en la atmósfera entre 1894 y 1898 por el matemático y físico británico John William Strutt Rayleigh y el químico británico William Ramsay. El segundo avance fue la interpretación de la causa de la periodicidad de los elementos en términos de la teoría de Bohr (1913) sobre la estructura electrónica del átomo.
LEY PERIÓDICA
Esta ley es la base de la tabla periódica y establece que las propiedades físicas y químicas de los elementos tienden a repetirse de forma sistemática conforme aumenta el número atómico.
Todos los elementos de un grupo presentan una gran semejanza y, por lo general, difieren de los elementos de los demás grupos. Por ejemplo, los elementos del grupo IA, a excepción del hidrógeno, son metales con valencia química +1; mientras que los del grupo VIIA), exceptuando el astato, son no metales, que normalmente forman compuestos con valencia -1.
¿PARA QUÉ NOS SIRVE LA TABLA PERIÓDICA?
Básicamente para catalogar cada elemento conocido y predecir la aparición de otros elementos faltantes. También es útil para enseñar a los estudiantes los nombres, características y funciones de cada elemento, por ello las tablas periódicas han sido incluidas en la gran mayoría de los sistemas educativos del mundo, pues facilitan mucho el aprendizaje sobre química y física.

La tabla periódica sirve entre otras cosas para:
- Aprender y conocer los elementos químicos de la naturaleza
- Predecir los nuevos elementos
- Catalogar los elementos según su tipo
- Predecir ciertas reacciones
- Calcular el peso atómico de una combinación
- Calcular algunas reacciones físicas
- Clasificar un elemento según su tipo
- Catalogar elementos nuevos
- Saber si un elemento es puro o sintético
- Se usa en física
- Se usa medicina
- Se usa en química
- Se usa en educación
- Se usa en investigación
- Se una en varias industrias
- Se usa en geología
- Se usa en la ciencia aeroespacial
- Se usa en la industria militar
- Su estudio ayuda a mejorar la memoria
- Su estudio ayuda a mejorar la concentración
La tabla periódica es usada para aprender los elementos
El estudio de la tabla periódica comienza en las escuelas, dependiendo del régimen educativo esta puede presentarse en primaria o durante la educación secundaria. Su uso se ha extendido a prácticamente todo el mundo, pues ha demostrado ser una forma muy práctica y útil para que aprender los nombres y algunas características de los elementos.
Hay distintos tipos de tablas periódicas, pues se van modificando según se encuentre un nuevo elemento, además algunos formatos cambian un poco según lo requieran los educadores o el plan de estudios de la institución educativa. Actualmente existen varios modelos de la tabla periódica, algunos ilustrados con dibujos para facilitar el aprendizaje a los niños, además el aprendizaje de la misma ayuda a entrenar la memoria de los niños y su concentración, pues se requiere saber los nombres de los elementos, sus caracterizas y sus pesos atómicos. Todas las tablas periódicas se actualizan conforme se descubren nuevos elementos, pero siguen el mismo principio creado por Mendeléyev.
La tabla periódica sirve para catalogar los elementos químicos:
La función primaria de la tabla periódica es la de ayudar a clasificar en cierto orden los distintos elementos, tanto los puros como los compuestos sintéticos que se han encontrado a lo largo de la historia.
La tabla periódica ha sido modificada varias veces desde su creación, pues distintos químicos y físicos han reclasificado los elementos, además se modifica cada vez que se descubren nuevos elementos, aunque para ello hay espacios vacíos en la tabla donde se predicen en qué lugar quedará el nuevo elemento descubierto.
La tabla periódica es utilizada en física, química y geología:
La tabla periódica es indispensable para las investigaciones y estudios en física, química y geología, pues es necesario el saber sobre elementos, su naturaleza, sus características atómicas y su composición. Y la tabla periódica es una forma fácil de acceder a la información de un elemento, tanto para clarificarlo como para saber las distintas reacciones que puede tener el elemento al pertenecer a un grupo determinado. En geología cuando se descubre algún mineral poco común, se analizan sus características químicas y se cataloga en su lugar correspondiente de la tabla.
En la medicina e industria:
Es necesario el conocimiento de la tabla periódica y de la naturaleza de los distintos elementos, para la elaboración de muchos productos químicos. En la medicina se emplean muchos elementos, algunos en estado puro como parte de medicamentos y otros combinados o alterados como parte de utensilios o aparatos. Además es necesario saber la reacción de cada elemento en el organismo, tanto por sus funciones naturales necesarias, como por los efectos nocivos que provocan en el organismo. Para ello es necesario el aprender la tabla periódica y estudiar detenidamente los distintos elementos y sus reacciones.
En las diversas industrias, como la petrolera, la farmacéutica, la alimentaria, la química, y la nuclear, se emplea la tabla periódica para saber las características de los elementos que son empleados en cada una. Así por ejemplo es utilizado por la ingeniería nuclear para saber las peculiaridades de los elementos radiactivos que se emplean y los efectos de otros elementos sobre ellos.
HISTORIA DE LA TABLA PERIÓDICA
Los orígenes de la tabla periódica se remontan al año 1789, cuando Antoine Lavoiser publicó una lista de 33 elementos químicos, agrupándolos en gases, metales, no metales y tierras. Pese a que era muy práctica y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias tanto en las propiedades físicas como en las químicas.
Los químicos pasaron al siglo siguiente buscando un esquema de clasificación más preciso. Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlos con los pesos atómicos se debe al químico alemán Johann Wolfgang quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último, después en el año de 1827 señaló la existencia de otros grupos en los que se observaba la misma relación como el cloro, bromo y yodo etc.
Durante el siglo XIX, los químicos comenzaron a clasificar los elementos conocidos de acuerdo a la similitud de sus propiedades físicas y químicas como:
- El descubrimiento de los elementos de la tabla periódica.
- El estudio de las propiedades comunes y la clasificación de los elementos
- La noción de masa atómica (inicialmente llamada “peso atómico”), y posteriormente en el siglo XX, número atómico.
- Las relaciones entre la masa atómica y las propiedades periódicas de los elementos y la aparición de nuevos elementos.
En el año 1829, el químico J.W. Döbenreiner organizó un sistema de clasificación de elementos en el que éstos se agrupaban en conjuntos de tres denominados triadas. El químico alemán Leopold Gmelin trabajó con este sistema, y en 1843 identificó diez tríadas, tres grupos de cuatro, y un grupo de cinco.
En 1857 Jean Baptiste Dumas publicó el trabajo que describe las relaciones entre los diversos grupos de metales. Este mismo año el químico alemán August Kekulé observó que el carbono estaba unido a otros cuatro átomos.
Para el año 1860 los científicos ya habían descubierto más de 60 elementos diferentes y habían determinado su masa atómica.
En el año 1862, el geólogo francés Chancourtois, organizó la “hélice telúrica” colocando los elementos en orden creciente de peso atómico sobre una hélice.
Para el año 1869 el químico ruso Dmitri Ivanovich Mendeléyev desarrolló una tabla periódica de los elementos según el orden creciente de sus masas atómicas, publicando su primera versión en ese mismo año; siendo a quien se le atribuyó la invención de esa tabla.
En 1867 Gustavus Hinrichs (químico danés), publicó un sistema periódico en espiral sobre la base de los espectros, los pesos atómicos y otras similitudes químicas.
Para el año 1871 Dmitri Ivanovich y Lothar Meyer propusieron la tabla periódica ordenando los elementos químicos que conocían según su peso atómico creciente, en grupos de siete elementos. Incluso dejaron lugares libres para los elementos que aún no se conocían, a los que llamaron: “Ekaboro ekaaluminio ekasilicio”.
El reconocimiento y la aceptación de la tabla de Mendeléyev fue a partir de dos decisiones tomadas: La primera fue dejar huecos cuando parecía que el elemento correspondiente todavía no había sido descubierto y la segunda decisión fue ignorar el orden sugerido por los pesos atómicos y cambiar los elementos adyacentes, como (telurio y yodo), para clasificarlos mejor en familias químicas.
En 1886 se descubrieron los elementos predichos por Mendeléyev, a los cuales se les llamó: Escandio Galio Germanio. Fue extraordinaria la concordancia entre las propiedades encontradas y las anunciadas. El mundo científico finalmente acepto la tabla periódica propuesta por el químico ruso.
Para el año 1895, Lord Rayleigh informó del descubrimiento de un nuevo elemento gaseoso llamado Argón, que resultaba ser químicamente inerte. Este elemento no encajaba en ninguno de los grupos conocidos de la tabla periódica.
En el año 1898, William Ramsey sugirió que el argón se colocara entre el cloro y el potasio en una familia con el helio, a pesar del hecho de que el peso atómico del argón era mayor que el del potasio. Este grupo fue llamado “grupo cero” debido a la valencia cero de estos elementos. Ramsey predijo con precisión el descubrimiento futuro del neón y sus propiedades.
En el año 1904, se completó la tabla periódica con un nuevo grupo compuesto por gases nobles.
Para el año 1911, Ernest Rutherford publicó sus estudios sobre la emisión de partículas alfa por núcleos de átomos pesados que llevaron a la determinación de la carga nuclear. Demostró que la carga nuclear en un núcleo era proporcional al peso atómico del elemento. Ese mismo año también, A. van der Broek propuso que el peso atómico de un elemento era aproximadamente igual a la carga. Esta carga, más tarde llamada número atómico, podría usarse para numerar los elementos dentro de la tabla periódica.
En 1913, Henry Moseley determinó los valores experimentales de la carga nuclear o número atómico de cada elemento, y demostró que el orden de Mendeléyev corresponde efectivamente al que se obtiene de aumentar el número atómico.
Los últimos cambios importantes en la tabla periódica fueron el resultado de los trabajos de Glenn Seaborg a mediados del siglo XX. En 1940 comenzó con el descubrimiento del plutonio y después, el de los elementos transuránicos del 94 al 102. Seaborg, reconfiguró la tabla periódica poniendo la serie de los actínidos debajo de la serie de los lantánidos.
El 30 de diciembre de 2015, la IUPAC reconoció oficialmente los elementos 113, 115, 117, y 118, completando la séptima fila de la tabla periódica.
Para el 28 de noviembre del año 2016, se anunciaron los nombres oficiales y los símbolos de los últimos cuatro nuevos elementos aprobados hasta la fecha por la IUPAC (Nh, nihonio; Mc, moscovio; Ts, tenesio; y Og, oganesón), que sustituyen a las designaciones temporales.
CONCEPTO DE LA TABLA PERIÓDICA
La tabla periódica es un esquema en forma de tabla donde figuran todos los elementos químicos que se conocen, sistemáticamente ordenados de acuerdo a sus números atómicos, en orden creciente. Están dispuestos en dieciocho columnas verticales por grupos de elementos de similares propiedades, pues poseen igual valencia atómica. Estos grupos son: los metales alcalinos, los metales alcalinotérreos, los pertenecientes a las familias del escandio, titanio, vanadio, cromo, manganeso, hierro, cobalto, níquel, cobre, zinc, térreos, carbonoideos, nitrogenoideos, calcógenos, halógenos y gases nobles.
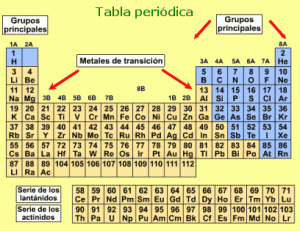
Cuenta además, con siete filas o períodos horizontales, donde se colocan los elementos por sus masas similares, aunque tienen diferentes propiedades.
A la izquierda y en el centro de la tabla se ubican los metales, que son los elementos más abundantes. A la derecha están los no metales, exceptuando los gases nobles.
En la parte superior de la tabla podemos visualizar una clave, que tiene la virtud de aclarar a modo de ejemplo, el significado que poseen los números que se hallan en el recuadro que corresponde a cada uno de los elementos.
En bloque separado, en la parte inferior de la tabla, están los elementos llamados de transición interna.
Cada símbolo posee un color diferente, que indica su estado de agregación, o sea, si la temperatura-ambiente es líquido, sólido o gaseoso.
ÍNDICE
- Concepto de la tabla periódica
- Historia de la tabla periódica
- ¿Para que sirve la tabla periódica?
- Ley periódica
- Desarrollo histórico
- Teoría de la capa electrónica
- Teoría cuántica
- Trabajos de Niels Bhor
- Conclusiones
- Fuentes de consulta
- Vídeo; Química: introducción a la Tabla Periódica
- Vídeo; La tabla periódica. Clasificación de los elementos
INTRODUCCIÓN
INTRODUCCIÓN
La tabla periódica se ha vuelto tan familiar que forma parte del material didáctico para cualquier estudiante, más aún para estudiantes de química, medicina e ingeniería. De la tabla periódica se obtiene información necesaria del elemento químico, en cuanto se refiere a su estructura interna y propiedades, ya sean físicas o químicas.
La actual tabla periódica moderna explica en forma detallada y actualizada las propiedades de los elementos químicos, tomando como base a su estructura atómica.
Según sus propiedades químicas, los elementos se clasifican en metales y no metales. Hay más elementos metálicos que no metálicos. Los mismos elementos que hay en la tierra existen en otros planetas del espacio sideral. El estudiante debe conocer ambas clases, sus propiedades físicas y químicas importantes; no memorizar, sino familiarizarse, así por ejemplo familiarizarse con la valencia de los principales elementos metálicos y no metálicos, no en forma individual o aislada, sino por grupos o familias (I, II, III, etc) y de ese modo aprender de manera fácil y ágil fórmulas y nombres de los compuestos químicos, que es parte vital del lenguaje químico.
Es por ello que invitamos a usted a dar una lectura al presente trabajo, con el motivo que se entere de los diferentes comportamientos que tienen los elementos y compuestos químicos en procesos de laboratorio, e incluso, que suceden en la vida real.
La actual tabla periódica moderna explica en forma detallada y actualizada las propiedades de los elementos químicos, tomando como base a su estructura atómica.
Según sus propiedades químicas, los elementos se clasifican en metales y no metales. Hay más elementos metálicos que no metálicos. Los mismos elementos que hay en la tierra existen en otros planetas del espacio sideral. El estudiante debe conocer ambas clases, sus propiedades físicas y químicas importantes; no memorizar, sino familiarizarse, así por ejemplo familiarizarse con la valencia de los principales elementos metálicos y no metálicos, no en forma individual o aislada, sino por grupos o familias (I, II, III, etc) y de ese modo aprender de manera fácil y ágil fórmulas y nombres de los compuestos químicos, que es parte vital del lenguaje químico.
Es por ello que invitamos a usted a dar una lectura al presente trabajo, con el motivo que se entere de los diferentes comportamientos que tienen los elementos y compuestos químicos en procesos de laboratorio, e incluso, que suceden en la vida real.
Suscribirse a:
Comentarios (Atom)





